Las Buenas Prácticas Clínicas (BPC) son un estándar para los ensayos clínicos que abarcan el diseño, conducción, seguimiento, auditorias, análisis, registros, información y documentación de ensayos clínicos, que asegura que los estudios son válidos ética
y científicamente y que las propiedades clínicas del producto farmacéutico (diagnósticas, profilácticas o terapéuticas) bajo investigación están convenientemente documentadas (1).
Son un conjunto de directrices éticas y científicas que garantizan la calidad y la integridad de los ensayos clínicos. Estas prácticas son fundamentales para proteger los derechos, la seguridad y el bienestar de los participantes, así como para asegurar la validez y confiabilidad de los datos obtenidos. En los últimos cinco años, las BPC han evolucionado para adaptarse a los avances tecnológicos y a los cambios en la regulación global.
En un entorno de investigación que evoluciona rápidamente, es vital que las BPC se actualicen constantemente para reflejar los avances en ciencia, tecnología y ética. Este artículo examina las tendencias actuales en BPC y su impacto en la investigación y la práctica clínica, proporcionando una guía exhaustiva para investigadores, académicos y profesionales de la salud.
- Historia y evolución de las Buenas Prácticas Clínicas
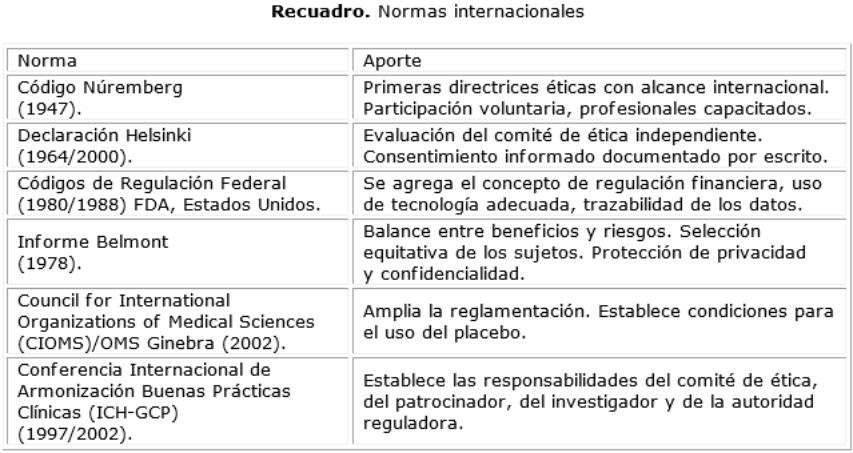
Múltiples antecedentes históricos dieron lugar a la aparición de las guías que regulan el desarrollo de la investigación clínica en seres humanos. Los principales códigos y declaraciones sobre la regulación de la investigación médica aparecieron como respuesta a acontecimientos específicos.
Las Guías Internacionales para la realización de estudios clínicos se publicaron en 1996 y entraron en vigencia en 1997. Iniciativa conjunta de las autoridades reguladoras y de la industria farmacéutica para desarrollar discusiones técnicas y científicas sobre los requerimientos necesarios para garantizar la seguridad, calidad y eficacia de los medicamentos. Estándar ético y científico para diseñar, conducir, registrar, analizar y reportar estudios que involucran la participación en humanos.
En el continente americano no todos los países forman parte de la Conferencia Internacional de Armonización. (ICH) Sin embargo, la realización de estudios clínicos cada vez en fases más tempranas, conllevó a definir criterios armonizados de BPC a través del documento de Las Américas. Se siguieron estrictos principios éticos y científicos que sirven de base tanto para las agencias reguladoras, investigadoras, comités de ética, universidades y empresas y la misión es promover la armonización de los aspectos de regulación sanitaria sobre calidad, seguridad y eficacia de los medicamentos como contribución a la calidad de vida y el cuidado de la salud de la población de los países de Las Américas (1).
Normas Internacionales

- Avances tecnológicos en Investigación Clínica
La tecnología ha transformado la investigación clínica de maneras que antes eran inimaginables. La digitalización, la inteligencia artificial (IA) y los dispositivos portátiles están revolucionando la forma en que se llevan a cabo los ensayos clínicos.
-Digitalización y registros electrónicos
La implementación de registros electrónicos de salud (EHR) ha cambiado radicalmente la manera en que se recopilan y gestionan los datos clínicos. Estos sistemas permiten un acceso más rápido y eficiente a la información, facilitando la recolección de datos en tiempo real. Esto no solo mejora la calidad de los datos, sino que también permite una monitorización más cercana de los participantes.
La digitalización permite la integración de datos de múltiples fuentes, lo que facilita un análisis más completo y preciso. Además, la automatización de procesos reduce la carga administrativa para los investigadores, permitiéndoles centrarse en aspectos más críticos de sus estudios.
-Telemedicina y Ensayos Clínicos
La telemedicina ha emergido como una herramienta esencial especialmente en el contexto de la pandemia de Covid 19. Permite la realización de consultas y seguimientos a distancia, lo que puede aumentar la participación de los pacientes y facilitar el acceso a los ensayos clínicos.
Se requieren estrategias de investigación innovadoras para producir evidencias de alta calidad que permitan la interpretación de diagnósticos y terapias desde entornos de investigación a entornos clínicos para mejorar la salud de la población.
Los ensayos clínicos que incorporan la telemedicina han demostrado ser más accesibles para los pacientes, especialmente aquellos que viven en áreas rurales o que tienen dificultades para desplazarse. Esto no solo mejora la diversidad de los participantes sino que también ayuda a obtener datos más representativos.
-Inteligencia artificial (IA) y análisis de datos
La Inteligencia Artificial está revolucionando la forma en que se analizan los datos clínicos. Herramientas de aprendizaje automático pueden identificar patrones en grandes conjuntos de datos que serían difíciles de detectar manualmente. Esto puede llevar a descubrimientos más rápidos y a una mejor personalización de los tratamientos.
La capacidad de la IA para analizar datos de manera eficiente permite la personalización de los tratamientos, adaptando las intervenciones a las características individuales de los pacientes. Esto es especialmente relevante en áreas como la oncología, donde los tratamientos pueden ser ajustados según el perfil genético del paciente.
Los estudios futuros estarán soportados en inteligencia artificial, aprendizaje automático y redes neuronales que permitirá mejorar el descubrimiento de fármacos, la interpretación de imágenes. Racionalización de datos en los registros médicos electrónicos y la mejoría en el flujo de trabajo. Los estudios se adaptarán a los avances recientes en inmunología y medicina de precisión. También serán más descentralizados y virtualizados, comprenderán criterios de valoración digitalizados para un seguimiento realista y estandarizado de las experiencias del paciente en el mundo real, lo que facilitará el monitoreo remoto.
Otra capacidad que tendrán será la de responder a múltiples preguntas de investigación mediante técnicas avanzadas como el big data. Actualmente los criterios de valoración son multidimensionales y abarcan resultados metabólicos, cardiovasculares y renales en un solo estudio. Es importante entonces realizar nuevos diseños que permitan la integración con los registros de salud pública utilizando estudios aleatorizados basados en registros y datos fiables de los registros clínicos electrónicos.
Otro avance a considerar es el de los biomarcadores y los estudios de imágenes asociados a la IA, donde esta información mejorará la inclusión de pacientes en los estudios y el enfoque en subgrupos específicos que se beneficiarían de una terapia en particular o de un objeto de investigación. Es decir, pasaremos de diseños de estudios de un solo órgano a un enfoque multiorgánico, con el entrecruzamiento de información de diferentes sistemas.
Por otro lado, el avance de los sensores y dispositivos portátiles permite la recolección de datos y el monitoreo remoto, lo cual representa otro punto de mejora en la eficiencia de los estudios en el futuro. Todas estas consideraciones sobre el avance de la tecnología deben tener un sustento fundamental: la confiabilidad y calidad de los datos disponibles. Sin ello, persistirá el sesgo de inclusión, los resultados y su generalización se verán seriamente afectados
Los avances de la tecnología favorecerá una inclusión menos restrictiva de la población, un enfoque centrado en el paciente, diseños más pragmáticos e identificación de subgrupos como objetivo de investigación, mejorará la calidad de la evidencia con mayor eficiencia en la generalización y en la gestión de poblaciones hasta ahora excluidas de los ensayos clínicos (2),(3),(4), (5).
III. Énfasis en la ética y la Inclusión
La ética en la investigación ha cobrado una importancia sin precedentes en los últimos años. Las BPC modernas no solo se enfocan en el cumplimiento regulatorio, sino que también promueven la inclusión y la participación activa de los pacientes.
-Consentimiento Informado
El consentimiento informado es un principio fundamental de las BPC. A medida que la investigación se vuelve más compleja, es esencial que los participantes comprendan completamente los riesgos y beneficios de los ensayos clínicos. Las BPC actuales enfatizan la necesidad de que el consentimiento sea un proceso continuo, no solo un documento que se firma al inicio del estudio.
Las estrategias para obtener el consentimiento informado están evolucionando. El uso de videos, infografías y aplicaciones interactivas puede ayudar a los participantes a comprender mejor los detalles del estudio, lo que puede aumentar la tasa de aceptación y la retención de los participantes (6),(7).
-Inclusión de pacientes en la investigación
La inclusión activa de los pacientes en el diseño y la ejecución de estudios clínicos es una tendencia creciente. Esto no solo mejora la calidad de los estudios, sino que también asegura que las investigaciones sean relevantes y respondan a las necesidades de los pacientes.
Los modelos de investigación colaborativa, que involucran a pacientes como co-investigadores, están ganando popularidad. Esto permite que las perspectivas de los pacientes sean integradas desde el inicio, lo que puede mejorar la relevancia y la aplicabilidad de los resultados (2).
- Nuevas regulaciones y directrices
Las regulaciones y directrices en torno a las BPC están en continua evolución. Organismos internacionales están actualizando sus normativas para adaptarse a las nuevas realidades de la investigación clínica.
– Cumplimiento normativo
El cumplimiento de las regulaciones es esencial para la validez de los estudios clínicos. Las BPC establecen estándares que deben cumplirse para garantizar la calidad y la ética de la investigación. La falta de cumplimiento puede llevar a sanciones severas y a la pérdida de credibilidad.
La formación continua es vital para que los investigadores y profesionales de la salud se mantengan actualizados sobre las nuevas regulaciones. Esto no solo asegura el cumplimiento, sino que también mejora la calidad de la investigación.
-Tendencia en regulaciones internacionales
Las regulaciones internacionales están cada vez más alineadas, lo que facilita la colaboración entre países. Esto es especialmente importante en la investigación de medicamentos y tratamientos que requieren ensayos clínicos en múltiples países.
La colaboración internacional en ensayos clínicos ha aumentado, permitiendo que los investigadores compartan datos y recursos. Esto no solo acelera el proceso de investigación, sino que también mejora la calidad de los resultados (8), (9).
- Desafíos y oportunidades futuras
A pesar de los avances en BPC, aún existen desafíos significativos que deben abordarse. La adaptación a nuevas tecnologías y regulaciones, así como la necesidad de mantener la ética en la investigación, son cuestiones críticas.
-Desafíos en la implementación
La implementación de nuevas tecnologías puede ser costosa y requerir una capacitación significativa. Además, la resistencia al cambio por parte de algunos investigadores y profesionales de la salud puede obstaculizar la adopción de nuevas prácticas.
Es fundamental desarrollar estrategias efectivas para abordar la resistencia al cambio. Esto puede incluir la formación y la sensibilización sobre los beneficios de las nuevas tecnologías y prácticas, así como la creación de incentivos para su adopción.
-Oportunidades para la Innovación
A pesar de los desafíos, hay numerosas oportunidades para la innovación en el campo de las BPC. La integración de la IA, la telemedicina y otras tecnologías emergentes puede llevar a una mejora significativa en la calidad y la eficiencia de la investigación clínica.
Futuro de las Buenas Prácticas Clínicas
El futuro de las BPC parece prometedor, con un enfoque creciente en la personalización y la inclusión. A medida que la investigación continúa evolucionando, es esencial que las BPC se adapten para reflejar estos cambios y seguir protegiendo a los participantes y asegurando la calidad de los estudios (2).
Si estás buscando asesorías académicas personalizadas para potenciar tu éxito en la educación, ¡estamos aquí para ayudarte! Nuestra empresa se especializa en ofrecer servicios de asesoría académica de alta calidad, respaldados por la investigación educativa y la experiencia de nuestros profesionales. Descubre cómo podemos colaborar contigo en tu camino hacia el conocimiento y el aprendizaje efectivo. ¡Contáctanos hoy mismo para obtener orientación experta y alcanzar tus metas académicas!
Consideraciones Finales
Las Buenas Prácticas Clínicas son esenciales para garantizar la integridad y la calidad de la investigación médica. Este artículo ha destacado la importancia de actualizar y adaptar estas prácticas a las tendencias emergentes y a las innovaciones tecnológicas. Para los investigadores y profesionales de la salud, es crucial mantenerse informados y comprometidos con la mejora continua de las BPC.
Para los ensayos clínicos, el futuro se puede resumir en los siguientes puntos. Centrados en el paciente, utilización de tecnologías y estudios descentralizados para reducir la carga. Mejora en la exactitud de datos mediante la incorporación de bases de datos electrónicas más parametrizadas y confiables. Mayor disponibilidad y calidad de datos del mundo real. Énfasis en la experiencia del paciente. Agilización, adaptación, flexibilización del diseño de estudios para adaptarse a los cambios de contexto. Mayor eficiencia en la infraestructura de la investigación clínica, incluyendo telemedicina, captura de datos remotos y monitoreo remoto.
Este artículo proporciona una información clara sobre las tendencias actuales en BPC y el futuro de los ensayos clínicos, sirviendo como recurso valioso para aquellos que buscan mejorar sus prácticas y contribuir al avance de la investigación médica. Con un compromiso renovado hacia la ética y la innovación, el futuro de las Buenas Prácticas Clínicas es brillante y está lleno de oportunidades.
Recomendaciones para Investigadores e Instituciones
- Formación continua: Participar en programas de formación sobre las últimas regulaciones y tecnologías.
- Involucrar a los pacientes: Fomentar la participación activa de los pacientes en el diseño y ejecución de estudios.
- Adoptar nuevas tecnologías: Estar abiertos a la implementación de herramientas digitales y de IA para mejorar la recolección y análisis de datos.
- Promover la ética: Establecer políticas claras que promuevan la ética y la inclusión en la investigación.
- Facilitar la colaboración: Crear plataformas que faciliten la colaboración entre investigadores de diferentes disciplinas y regiones.
- Evaluar y actualizar: Realizar evaluaciones periódicas de las prácticas de BPC y actualizarlas según sea necesario.
Referencias Bibliográficas
1. Cardonne TM, Buch AH, Rosales MC, Semanat DYG, Lora LV. Certificación en Buenas Prácticas Clínicas de un sitio clínico. Rev Cuba Salud Pública [Internet]. 2014 [citado 2 de septiembre de 2024];40(4):392-402. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=53806
2. Masson W. El futuro de los ensayos clínicos. Acta Gastroenterológica Latinoam [Internet]. 1 de julio de 2024 [citado 2 de septiembre de 2024];54(2):115-8. Disponible en: http://actaojs.org.ar/ojs/index.php/acta/article/view/418
3. García-Minguillán López O. Ensayo clínico pragmático para evaluar la efectividad del software anticonceptivo Natural Cycles. 10 de julio de 2023 [citado 2 de septiembre de 2024]; Disponible en: http://dspace.umh.es/handle/11000/30186
4. Rosillo N, Bueno H. Integración de fuentes de datos: una herramienta clave para optimizar recursos, y priorizar áreas de mejora en clínica y epidemiología. Rev Esp Cardiol [Internet]. 1 de junio de 2024 [citado 30 de agosto de 2024];77(6):459-61. Disponible en: https://www.sciencedirect.com/science/article/pii/S0300893223005390
5. Álvarez Cardona M, Palomino Hernández L, Sánchez Valdés L, Montes D Santis A. Sistema para el manejo de datos de ensayos clínicos XAVIA SIDEC, su uso durante la pandemia Covid 19 [Internet]. [citado 2 de septiembre de 2024]. Disponible en: https://convencionsalud.sld.cu/index.php/convencionsalud22/2022/paper/viewFile/1271/493
6. Bustos Saldaña R. La dignidad de las personas en las investigaciones clínicas. Med Ética [Internet]. marzo de 2023 [citado 30 de agosto de 2024];34(1):123-59. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_abstract&pid=S2594-21662023000100123&lng=es&nrm=iso&tlng=es
7. Martínez Medina PA, Celis LG, Martínez Medina PA, Celis LG. Los desafíos de los comités de ética en investigación clínica en Latinoamérica. Rev Salud Uninorte [Internet]. abril de 2023 [citado 30 de agosto de 2024];39(1):1-4. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_abstract&pid=S0120-55522023000100001&lng=en&nrm=iso&tlng=es
8. Guerra SA. La norma ISO 9001, las buenas prácticas clínicas y de laboratorio en los ensayos clínicos. Rev Cuba Med Mil [Internet]. 15 de julio de 2022 [citado 2 de septiembre de 2024];51(3):02202093. Disponible en: https://revmedmilitar.sld.cu/index.php/mil/article/view/2093
9. Fernández Nin AE, García Agustín D, Stable García Y, Menéndez Imamura K, Pérez Sosa S, Urrutia Amable N, et al. RETOS DE LOS ENSAYOS CLÍNICOS EN EL ADULTO MAYOR. Rev CENIC Cienc Biológicas [Internet]. 2023 [citado 2 de septiembre de 2024];54:37-43. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S2221-24502023000100037&lng=es&nrm=iso&tlng=es


0 comentarios